Τράπεζα Θεμάτων Α' Λυκείου - Φύλλο 20649
Λύνουμε το φύλλο 20649 από την Τράπεζα Θεμάτων της Α' Λυκείου.
Θέμα χωρίς ιδιαίτερη δυσκολία τόσο στη Θεωρία όσο και στην Άσκηση. Αποτελούν όμως μια ευκαιρία για αξιολόγηση του επιπέδου μας και των πιθανών σημείων που δεν έχουμε κατανοήσει πλήρως.
Στοιχειομετρία
Στοιχειομετρία με απλά λόγια είναι η σχέση που εμφανίζουν τα αντιδρώντα και τα προϊόντα μεταξύ τους. Γνωρίζοντας για παράδειγμα την ποσότητα ενός αντιδρώντος σε μια ισοσταθμισμένη χημική εξίσωση μπορούμε να προβλέψουμε ποια ποσότητα ενός προϊόντος θα παραχθεί.
Στοιχειομετρία - Παράδειγμα 1
Στοιχειομετρία - Παράδειγμα 2
Περιοριστικός Παράγοντας
Τράπεζα Θεμάτων Α' Λυκείου
Απο την νέα τράπεζα θεμάτων , μπορείτε να βρείτε εδω δυο παραδείγματα με τις προτεινόμενες λύσεις τους.
ΔΟΜΗ ΑΤΟΜΟΥ
Άτομο ονομάζουμε το μικρότερο σωματίδιο της ύλης το οποίο μπορεί να συμμετάσχει σε χημικές αντιδράσεις. Για να αρχίσουμε να κατανοούμε τη Χημεία, είναι απαραίτητη η γνώση της δομής του ατόμου.
Το άτομο αποτελείται απο δύο "περιοχές":
α. τον πυρήνα
β. τις τροχιές γύρω απο τον πυρήνα (στιβάδες)
Το σχήμα ενός ατόμου μπορούμε να το φανταστούμε σαν το ηλιακό μας σύστημα, με τον ήλιο στο κέντρο (πυρήνας) και τους πλανήτες σε τροχιές γύρω από τον ήλιο (στιβάδες).
To ηλιακό μας σύστημα
Το άτομο
Στον πυρήνα συναντούμε τα Πρωτόνια (p, protons) και τα Νετρόνια (n, neutrons), ενώ στις στιβάδες τα Ηλεκτρόνια (e, electrons).
Συνήθως όταν μας δίνεται ένα στοιχείο έχει τον ακόλουθο συμβολισμό.
Το Α ονομάζεται ΜΑΖΙΚΟΣ αριμός και δείχνει τον αριθμό των πρωτονίων και νετρονίων στον πυρήνα.
Το Ζ ονομάζεται ΑΤΟΜΙΚΟΣ αριθμός και δείχνει τον αριθμό των πρωτονίων στον πυρήνα.
Ο ΑΤΟΜΙΚΟΣ αριθμός αποτελεί την "ταυτότητα" του κάθε στοιχείου. Ατομικό αριθμό 11 έχει μόνο το Νάτριο, ατομικό αριθμό 8 έχει μόνο το Οξυγόνο κτλ.
Το Χ έχει κάθε φορά το σύμβολο του στοιχείου.
π.χ. μιλώντας για τον άνθρακα ο οποίος συμβολίζεται με το C, έχουμε:
Ό συμβολισμός αυτός μας δίνει τις εξής πληροφορίες:
α. Α=12
β. Ζ=6
γ. το στοιχείο είναι ο άνθρακας
Αφου το Ζ=6 σημαίνει ότι στον πυρήνα έχει 6 πρωτόνια.
Αφου το Α=12 σημαίνει οτι μαζί τα πρωτόνια και τα νετρόνια στον πυρήνα είναι 12.
Επίσης παρατηρώ ότι στην πάνω δεξιά μεριά του στοιχείου δεν υπαρχει + ή - άρα το στοιχείο μου είναι ουδέτερο, δηλαδή έχει τον ίδιο αριθμό πρωτονίων και ηλεκτρονίων.
Αρα: p=6
p+n=12 => n=6
p=e => e=6
Τελικά το στοιχείο μας (άνθρακας) αποτελείται απο 6 πρωτόνια, 6 νετρόνια και 6 ηλεκτρόνια.
Στην περίπτωση που έχουμε ένα ιόν, θετικό (κατιόν) ή αρνητικό (ανιόν), σημαίνει ότι έχει μεταβληθεί ο αριθμός των ηλεκτρονίων σε σχέση με το ουδέτερο άτομο.
Δεν αλλάζουμε ποτέ τα πρωτόνια του πυρήνα γιατί τότε θα μιλούσαμε για ένα διαφορετικό στοιχείο.
Για παράδειγμα :
Παρατηρούμε ότι έχει:
Μαζικό αριθμό Α=35, δηλαδή 35 πρωτόνια και νετρόνια.
Ατομικό αριθμό Ζ=17, δηλαδή 17 πρωτόνια.
Το - σημαίνει -1, δηλαδή το στοιχείο έχει 1 ηλεκτρόνιο παραπάνω από ότι πρωτόνια.
Έτσι έχουμε:
17 πρωτόνια
35-17=18 νετρόνια
Όσον αφορά τα ηλεκτρόνια, ΑΝ είχαμε ουδέτερο άτομο, τότε θα είχε το ίδιο πλήθος ηλεκτρονίων με το πρωτόνια δηλαδή 17 ηλεκτρόνια. ΑΛΛΑ έχουμε αρνητικό ιόν (ανιόν) και μάλιστα με φορτίο - (εννοείται -1)
Αρα για τα ηλεκτρόνια έχουμε 1 περισσότερο σε σχέση με τα πρωτόνια, δηλαδή 18 ηλεκτρόνια.
ΚΑΤΑΝΟΜΗ ΗΛΕΚΤΡΟΝΙΩΝ ΣΕ ΣΤΙΒΑΔΕΣ
Όπως είπαμε γύρω από τον πυρήνα υπάρχουν στιβάδες. Σκεφτείτε τις στιβάδες σαν ράφια στη βιβλιοθήκη σας. Κάθε ράφι είναι σε διαφορετικό ύψος και μπορεί να χωρέσει κάποιο αριθμό βιβλίων.
Στις στιβάδες δεν έχουμε ύψος αλλά διαφορετική ενέργεια. Όσο πιο μακριά από τον πυρήνα είναι μια στιβάδα, τόσο μεγαλύτερη ενέργεια έχει και αυτή και τα ηλεκτρόνια που βρίσκονται σε αυτή.
Κάθε στιβάδα χαρακτηρίζεται από έναν αριθμό, τον ΚΥΡΙΟ ΚΒΑΝΤΙΚΟ ΑΡΙΘΜΟ (n).
Η πρώτη στιβάδα (πιο κοντινή στον πυρήνα) έχει n=1, η επόμενη n=2 κτλπ. Για λόγου απλότητας και καλύτερου συμβολισμού, έχουμε δώσει σε κάθε τιμή του n ένα γράμμα.
n=1 => K
n=2 => L
n=3 => M
n=4 => N
n=5 => O
Μιλήσαμε όμως και για χωρητικότητα των στιβάδων σε ηλεκτρόνια.
Ενας σύντομο τρόπος για να θυμόμαστε τον ΜΕΓΙΣΤΟ αριθμό ηλεκτρονίων που χωράει μια στιβάδα είναι :
όπου n είναι ο ΚΥΡΙΟΣ ΚΒΑΝΤΙΚΟΣ ΑΡΙΘΜΟΣ.
Για παράδειγμα, αν μας δίνουν το στοιχείο:
Έχουμε: πρωτόνια+νετρόνια=16
πρωτόνια = 8
αφού είναι ουδέτερο, πρωτόνια=ηλεκτρόνια=8
Άρα: πρωτόνια=8
νετρόνια=8
ηλεκτρόνια=8
Τα 8 ηλεκτρόνια θα κατανεμηθούν όπως τα βιβλία στα ράφια.
Στο πρώτο ράφι (στιβάδα Κ) 2 ηλεκτρόνια
οπότε για το επόμενο ράφι (στιβάδα) μένουν 8-2=6
Στο δεύτερο ράφι (στιβάδα L) 6 ηλεκτρόνια
Κατά την ηλεκτρονιακή δόμηση πρέπει να προσέξουμε τα εξής στοιχεία:
α. Η τελευταία στιβάδα ΔΕΝ μπορεί να έχει περισσότερα από 8 ηλεκτρόνια (εκτός από την πρώτη, Κ, η οποία μπορεί να πάρει μέχρι 2 ηλεκτρόνια).
β. Η προτελευταία στιβάδα ΠΡΕΠΕΙ να έχει απο 8-18 ηλεκτρόνια ( εκτός από την Κ η οποία μπορέι να πάρει μέχρι 2 ηλεκτρόνια).
Για παράδειγμα το ασβέστιο (Ca) έχει 20 ηλεκτρόνια στο άτομό του.
Αυτά θα κατανεμηθούν ως εξής:
Στην πρώτη στιβάδα (Κ) 2 ηλεκτρόνια (μένουν 18)
Στη δεύτερη στιβάδα (L) 8 ηλεκτρόνια (τόσα μπορεί να πάρει το μέγιστο, άρα μένουν 10 ηλεκτρόνια).
Στην τρίτη στιβάδα (Μ) μπορώ να βάλω και τα 10 ηλεκτρόνια που μου μένουν γιατί έχει αυτη την χωρητικότητα (μεχρι18 ηλεκτρόνια) αλλά τότε η στιβάδα αυτή θα είναι η τελευταία και θα έχει 10 ηλεκτρόνια κάτι που δεν επιτρέπει ο πρώτος κανόνας. ΄
Για το λόγο αυτό θα βάλω 8 ηλεκτρόνια στην Μ στιβάδα και στην επόμενη στιβάδα θα βάλω αυτά που μου μένουν δηλαδή 2 ηλεκτρόνια.
Έτσι η κατανομή γίνεται:
Κ(2), L(8), M(8), N(2)
ΤΡΑΠΕΖΑ ΘΕΜΑΤΩΝ Α΄ ΛΥΚΕΙΟΥ

Εν αναμονή της νέας τράπεζας θεμάτων που θα δοθεί μέσα στο Νοέμβρη, στον παρακάτω σύνδεσμο δίνεται ολόκληρη η τράπεζα θεμάτων της Χημείας Α' Λυκείου στην οποία εξετάστηκαν οι μαθητές τον περασμένο Ιούνη.
Τράπεζα Θεμάτων Α' Λυκείου (12,2MB).
Στη συνέχεια δίνεται συνοπτικός πίνακας με τις αντιδράσεις οι οποίες ζητούνται στην Α' Λυκείου
Ακολουθούν πίνακες με τα ονόματα των ενώσεων που συναντούμε στην Α' Λυκείου.
Εισαγωγή στο 4ο Κεφάλαιο - Στοιχειομετρία
Κάθε φορά όταν έρθει ο κατάλληλος καιρός να μπούμε με τους μαθητές μου στο 4ο Κεφάλαιο-Στοιχειομετρία, τους λέω ότι ΤΩΡΑ αρχίζει η Χημεία. Αρχίζει μόλις ακούσει για πρώτη φορά την έννοια του mol. To κεφάλαιο αυτό είναι ίσως από τα σημαντικότερα, αλλά δεν έχει τύχει στο σχολείο της πρέπουσας σημασίας γιατί συνήθως γίνεται προς το τέλος της σχολικής χρονιάς, Για το λόγο αυτό παραθέτω την δική μου ματιά στο κεφάλαιο αυτό.
ΑΝΤΙΔΡΑΣΕΙΣ ΣΤΗΝ Α' ΛΥΚΕΙΟΥ
Στη συνέχεια δίνεται συνοπτικός πίνακας με τις αντιδράσεις οι οποίες ζητούνται στην Α' Λυκείου
ΟΝΟΜΑΤΟΛΟΓΙΑ ΣΤΗ Α' ΛΥΚΕΙΟΥ
Ακολουθούν πίνακες με τα ονόματα των ενώσεων που συναντούμε στην Α' Λυκείου.
Εισαγωγή στο 4ο Κεφάλαιο - Στοιχειομετρία
Κάθε φορά όταν έρθει ο κατάλληλος καιρός να μπούμε με τους μαθητές μου στο 4ο Κεφάλαιο-Στοιχειομετρία, τους λέω ότι ΤΩΡΑ αρχίζει η Χημεία. Αρχίζει μόλις ακούσει για πρώτη φορά την έννοια του mol. To κεφάλαιο αυτό είναι ίσως από τα σημαντικότερα, αλλά δεν έχει τύχει στο σχολείο της πρέπουσας σημασίας γιατί συνήθως γίνεται προς το τέλος της σχολικής χρονιάς, Για το λόγο αυτό παραθέτω την δική μου ματιά στο κεφάλαιο αυτό.






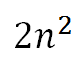




Δεν υπάρχουν σχόλια:
Δημοσίευση σχολίου